Академический Документы
Профессиональный Документы
Культура Документы
CH 5 Solutions Electrolytiques-1 Imp
Загружено:
Abdelhakim BailalОригинальное название
Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
CH 5 Solutions Electrolytiques-1 Imp
Загружено:
Abdelhakim BailalАвторское право:
Доступные форматы
Exercice
On dissout m=2 g dun hydrocarbure non
volatil dans m=100 g de benzne 20C. La
tension de vapeur de ce dernier sabaisse
de 74,66 74,01 mm Hg.
1.Calculer la masse molaire de cet
hydrocarbure
2.Donner sa formule brute sachant quil
renferme 94,4 % en masse de carbone.
Benzne : M=78 g.mol-1.
Exercice
10 14
y x
1
0
0
H C : 10 y et 14 x Soit
100
178
5,6. y et
100
178
94,4. 12x y 12x M
H C : brute Formule
% 5,6 H 94,4% C : masse en % ) 2
mol . g 178 M
' M
' m
M
m
M
m
n n
n
f
f
P
P
f . P P ) 1
= =
= = + =
= =
=
+
=
+
=
=
A
= A
Exemple 11
Un volume de 0,1 L de sang 0C est en
quilibre avec de lazote gazeux pur la
pression 2 atm.
1.Calculer le volume gazeux dazote dissous
dans le sang.
2.Mme question si on remplace lazote pur
par de lair ( 80% dazote , 20% doxygne)
la pression 2,5 atm.
Azote s = 0,023 L.L
-1
de sang. atm
-1
Exemple 11
1. v = s P
i
V = 0,023. 2. 0,1 = 4,6 mL
2. v = s P
i
V
P
i
= 2,5 . 0,8 = 2 atm ( Pression
partielle)
soit v= 4,6 mL
1.
Conductivit dune
solution
COMPORTEMENT DES
SOLUTIONS
ELECTROLYTIQUES
Rsistance lectrique
beaucoup plus faible que la
rsistance de leau pure
Entre deux solutions de
concentrations ioniques
diffrentes apparat une ddp
Principe de la conductivit
L
V
+
-
Ceq
S
S
E
U
-
.E U
+
.E
Dfinition de la conductivit
section de Surface S
Longueur L
) .m ( m / siemens
.m
1
S
L
G
RS
L
1 - 1
=
=
O = o
O =
= = = o
Rsistance et conductance
G
1
SU C F
L
R EL V
SUE C F Sv C F I
Svt C F SL C F Q
ionique Vitesse v ;
t
Q
I ;
I
V
R
eq
eq eq
eq eq
=
o
= =
o = o =
o = o =
= = =
Formule gnrale de la
conductivit
U C F
RS
L
eq
Remarques
La conductivit dpend :
1. de la concentration molaire du
solut
2. de la nature des ions
3. de la temprature
Conductivit dune solution
| |
1 1 2
eq anionique cationique
V . s . m U
anionique Mobilit E / v U
cationique Mobilit E / v U
Coulombs 500 96 Faraday F
) U U ( FC
courant le nt transporte ions les laquelle avec facilit : physique Sens
+ +
+
=
= =
= =
= =
+ o = o + o = o
Exemple 1
Soit une solution dacide chlorhydrique
de 10 mmole/l. Les mobilits des ions
H+ et Cl- sont respectivement gales
35 m/s et 7,63 m/s pour un champ
de 1 V/cm , une temprature de
25C.
Calculer la conductivit et la rsistivit
de cette solution.
Exemple 1
.m 34 , 2
1
.m 0,4263 0,0763 35 , 0
10 . 63 , 7 10 . 63 , 7 . 10 . 10 u . F . m
10 . 35 10 . 35 . 10 . 10 u . F . m
mole/m 10 L / mmole 10 m
V . s . m 10 . 63 , 7 u
V . s . m 10 . 35
) m . V ( 10
) s . m ( 10 . 35
u
1 1
2 8 5
2 8 5
3
1 1 2 8
1 1 2 8
1 2
1 6
O =
o
=
O = + = o + o = o
= = = o
= = = o
= =
=
= =
+
+ +
+
Conductivit quivalente
| |
+
A
A
= o
+ = A o
O = A
+ o =
o
= A
) U U ( F 1 : infinie Dilution
: limite e quivalent Conduction
Eq . m .
courant de transport au ion chaque de
le individuel ion Participat : ) U U ( F
C
1 2 1
eq
Exemple 2
La conductivit dune solution aqueuse dun
lectrolyte du type AB
2
de concentration
15 mmol.L
-1
est = 24
-1
.m
-1
. Sa
conductivit quivalente dilution infinie
est
=400
-1
.cm
-2
. Eq
-1
.
Calculer son degr de dissociation et sa
constante dquilibre.
Exemple 2
) (mol.m 1 ) (mol.L 10 K et 0,1
USI 10 . 4
Eq . m . . 10 . 400 Eq . cm . 400
mol.m 15 mol.L 015 , 0 m ; m . 24 : N . A
1
m 4
K
. m 4
. m 4
m 4 C
. C
2 3 - 2 1 - 6 -
2
1 2 1 4 1 2 1
3 - 1 - 1 1
2 3
eq
eq
= = = o
=
O = O = A
= = O = o
o
o
=
A
o
= o
A o
o
= o o =
A
o
=
A
A
= o
QCM1
Soit une solution lectrolytique , sel dun
acide faible. Quel(s) lment(s) ne
dpend(ent) pas de son coefficient de
dissociation :
A.La rsistivit de la solution
B.Le pH
C.La molarit
D.Labaissement cryoscopique
E.Losmolarit
QCM2
La migration lectrique :
A. est un transport de type passif
B. est en rapport avec un gradient de potentiel
lectrique
C. entrane un flux lectrique de solvant
D. est seule responsable du flux de la membrane
cellulaire
E. provoque un courant lectrique dont le sens
est toujours oppos au gradient de potentiel
QCM3
Une membrane dialysante spare deux solutions
lectrolytiques de concentration ingale. Dans lun
des compartiments se trouve une macromolcule
neutre, ltat dquilibre est tel que :
A.Llectroneutralit de part et dautre de la
membrane
B.Lgalit des concentrations de chaque ion de
part et dautre
C.Lexistence dune ddp entre les cts de la
membrane rapidement rsolutive
D.Ltablissement dune contre-pression osmotique
E.Un flux de migration non ngligeable
Relation conductivit-
concentration
m
H
2
SO
4
KOH
Relation cond. Eq. -
Concentration
m
Electrolytes forts
Electrolytes faibles
A
Ceq
Interprtation de la relation
cond. eq - concentration
Deux interprtations possibles :
m o Le nombre dions
( Valable pour les lectrolytes faibles)
o =1 Molcules compltement
dissocies ; m Activit ionique diminue
(cas des lectrolytes forts)
Activit dune solution
Concentration dune solution idale qui
prsenterait la mme conductivit que la
solution relle.
a = m
= Coefficient dactivit
Faible concentration : = 1
Forte concentration : < 1
2.
Mesure de la
conductivit
Conductimtrie
G = 1/R
CONDUCTIMETRE
QCM5
Concernant la mobilit dun ion soumis
laction dun champ lectrique
A. Elle est indpendante de la viscosit du
milieu
B. Elle est toujours identique pour deux
ions de mme charge
C. Elle dpend de lintensit du champ
lectrique
D. Elle seffectue toujours vitesse
croissante
E. Elle gnre une force de frottement
QCM6
Concernant la membrane cellulaire :
A.Les forces dues aux gradients transmembranaires
de concentration et de potentiel lectrique sont de
mme sens pour les ions K
+
et Cl
-
, mais elles sont
opposes pour lion Na
+
B.Elle a une face interne toujours lectrongative
C.Elle a une face externe lectropositive
D.La ddp est suprieure 50 mV dans le cas des
cellules excitables
E.Les mcanismes de transport actif explique la
constance des concentrations ioniques intra et
extracellulaires
Pont de Wheatstone
R
R
2
R
3
R
1
Equilibre R = R
1
R
2
/R
3
= k/R
k=L/S Facteur
gomtrique
Conductivit du plasma
1 - 1 2
corrig
mesur corrig
.cm 10 . 2 , 1
normale) (Valeur 75 - 70
(g/l) protines de Taux P
P 22 , 0 100
100
3.
Mobilit ionique
Dfinition
soit un ion dans un champ lectrique E,
qui se dplace dans un solvant ( avec
frottements). Sa vitesse est
constante en rgime permanent. On
dfinit la mobilit U
+
cation U
+
.E =v
et U
-
anion U
-
.E =v
Exemple 3
Etablir la dimension de la mobilit U en
lexprimant en masse (M), temps (T) et
intensit lectrique (I).
1 2
2
1
2
1
M . T . I U
T . L . M
T . I
. T . L U
T . I
T . L . M
q
F
E
T . L v ;
E
v
U
=
= = =
= =
Formule de la mobilit dun ion
friction de t coefficien f
lectron; charge e
; ion valence z ;
f
ze
f
Q
U
E . Q E . U . f v . f Equilibre
Aspects physico-chimiques de
la mobilit
La mobilit ionique est fonction
de la nature de lion (Q et r)
du milieu dans lequel il se dplace
it cos vis ; rayon r
r 6
Q
U
Exemple 4
V 10
7,2.10
1 , 0
.
100
10 . 7
L .
u
v
EL V
L
V
E
e 17 C 10 . 1 , 27
7,2.10 - . .10 .2.10 6 ru 6 Q
r 6 f avec
f
Q
E
v
u 2)
pH pH 0 Q : ampholytes Protines
0 Q ngative Mobilit ) 1
7 -
3
19
7 - 9 - 4 -
i
= = = = =
= =
t = tq =
tq = = =
Ordres de grandeur
Les mobilits ioniques : 2 10
microns/s pour un champ de
1V/cm ( 2.10
-8
10
-7
m
2
.V
-1
.s
-1
)
Les ions OH
-
et H
+
sont
beaucoup plus rapides : 20 et
30 microns/s.
QCM4
A.Pour les lectrolytes forts, o est toujours
gal 1 mais lactivit diminue quand la
concentration augmente
B.Lintensit du courant augmente avec la
concentration
C.Pour un lectrolyte faible, forte dilution le
coefficient dactivit tend vers 1
D.La force ionique caractrise lenvironnement
ionique
E.La force ionique du plasma est de 0,145
QCM7
La mobilit dun ion dans un champ
lectrique:
A. dpend dans certains cas du pH de la
solution aqueuse
B. dpend de la concentration
C. est la base de lanalyse par
lectrophorse
D. est fonction de la charge de lion
E. est sa vitesse de migration
Exemple 4
Une protine a une mobilit u= -7,2 10
-7
m.s/V.m-1
dans un milieu tampon liquide de pH=8,6 et de
viscosit =0,2mPa.s. Cette particule est sphrique
de rayon r=1nm.
1.Situer son pH isolectrique et calculer la charge
prise par cette particule ce pH.
2.Quelle tension faut-il appliquer entre les
lectrodes distantes de 10 cm pour quelle se
dplace de 7 mm en 100s?
Mobilit et courants ioniques
Courant cationique
Courant anionique
u u
u
I
I
t
+
u u
u
I
I
t
Exemple 5
Soit un acide AH dont lion A
-
a
une mobilit de 5m/s par
volt/cm. Quelle est la proportion
du courant cationique?
t
+
= 30/35 = 86 % par les ions
H
+
4.
Potentiel dlectrode
et loi de Nernst
Oxydation et rduction
Oxydation = perte dlectrons :
M =M
z+
+ ze-
M
z+
= Forme oxyde
Rduction = gain dlectrons
M
z+
+ ze- = M
M = Forme rduite
Exemple 3
Fe
2+
= Fe
3+
+ e
-
Reducteur = Oxydant + ze
-
Raction Redox
Potentiel dlectrode :
Formule de Nernst
Soit le couple rdox : Ox/Rd
o Ox + ne- = Rd
a
a
log
n
059 , 0
E E K 298 T
1) a a ( standard lectrode d' Potentiel E
volts) en E et E (
a
a
ln
nF
RT
E E
Rd
Ox
0
Rd Ox 0
0
Rd
Ox
0
|
o
|
o
+ = =
= = =
+ =
Exemple 4
Vrifier qu 25C, on a
1 -
1 - 1 -
96500C.mol faraday Le F
.mol J.K 8,31 R parfaits, gaz des te tan Cons R
: Donnes
X log
n
059 , 0
X ln
nF
RT
E
= =
= =
= =
Exemple 4
Sachant que lnX=ln10 x logX et que pour 25C ,
T = 298 K
X log
n
059 , 0
X log x 10 ln
96500n
298 x 31 , 8
X ln
96500n
298 x 31 , 8
=
=
Les diffrents types
dlectrodes
1.Llectrode mtallique (M
z+
/M)
2.Llectrode hydrogne
3.Llectrode mtallique inerte
(solution contenant forme oxyde et
forme rduite dune mme
substance, exemple Fe
3+
/ Fe
2+
)
Llectrode mtallique
Electrode mtallique plongeant dans une
solution dun de ses sels ( Couple M
z+
/M)
/Zn) Zn ( ZnSO dans Zn
standard Potentiel E
M log
z
059 , 0
) M / M ( E E
2
4
0
z z
0
+
+ +
=
+ =
Exemple5
Calculer le potentiel dune lame dargent
plongeant dans une solution de Ag NO
3
de
concentration m= 1 mmol.l
-1
.
On donne E
0
(Ag
+
/Ag) = 0,80 V
Ag=Ag
+
+e
-
E = E
0
+ 0,059 log m = 626
mV
Llectrode hydrogne
Couple H
+
/H
2
Une lectrode en platine dans une solution acide
contenant les ions H
+
Au contact de llectrode
il y a change de
-
entre H
+
et H
2
.
2 H
3
O
+
+ 2e
-
= H
2
(g) + H
2
O
| |
| |
normale) solution dans Electrode ( 0 E
O H log 058 , 0 E E atm 1 P
P
O H
log 059 , 0 E E
0
3 0
2
H
2
H
3
0
=
+ = =
+ =
Exemple 6
Calculer le potentiel dune lectrode
hydrogne ( p
H2
= 1 atm) plonge dans
chacune des solutions suivantes 20C.
1.HCl 0,1 mol.l
-1
2.HCOOH 0,15 mol.l
-1
( o = 0,03)
3.H
2
SO
4
0,1 mol.l
-1
4.NaOH 0,1 mol.l
-1
Exemple 6
V 754 , 0 10 log 059 , 0 E
10
- OH
Ke
O H mol.l 1 , 0 - OH . 4
mV 7 , 40 m 2 log 059 , 0 E 3.
mV 136 m log 059 , 0 E 2.
mV 58 O H log 059 , 0 E . 1
13
13
3
1 -
3
= =
= = =
= =
= o =
= =
+
+
Llectrode mtallique
inerte
Fe
Fe
log 059 , 0 ) Fe / Fe ( E E
Fe e Fe : Fe / Fe : Couple
standard Potentiel E
Rd
Ox
log 059 , 0 E E
2
3
2 3
0
2 3 2 3
0
0
+
+
+ +
+ + + +
+ =
= +
=
+ =
Exemple 7
1. Calculer le potentiel dune lectrode
inattaquable de platine plonge dans une
solution de sels ferreux et ferrique
concentrations gales sachant que
E(Fe
3+/
Fe
2+
)=0,77V
2. Calculer le potentiel lorsque[Fe
3+
]=2
[Fe
2+
]
Exemple 7
V 0,787 log2 0,059 V 0,77 E 2
Fe
Fe
V 77 , 0
Fe
Fe
log 058 , 0 E E
V 0,77 E e Fe Fe
2
3
2
3
0
0
3 2
= + = =
= + =
= + =
+
+
+
+
+ +
Oxydo-rduction
Une raction doxydation ne seffectue
quen prsence dun accepteur dlectrons
Couples : Ox
1
/Rd
1
et Ox
2
/Rd
2
Ox
1
+ n
1
e- = Rd
1
Rd
2
= Ox
2
+ n
2
e-
n
2
Ox
1
+ n
1
Rd
2
= n
2
Rd
1
+ n
1
Ox
2
Exemple 8
Oxydation du Cu
+
( cuivreux) par Fe
3+
( Ferrique)
Cu
+
= Cu
2+
+ e
-
Fe
3+
+ e
-
= Fe
2+
Cu
+
+ Fe
3+
= Cu
2+
+ Fe
2+
Pont salin
Pile lectrochimique
E
1
M
+
E
2
> E
1
N
+
KCl concentr
mV
m
1
m
2
+
-
I
e
-
Anode Cathode
Cl
-
K
+
f.e.m dune pile
| |
| |
m
m
log
z
059 , 0
E : z valence de
mtal mme un d' s constitue sont lectrodes les Si
m log
z
059 , 0
E E
m log
z
059 , 0
E E
E E E
1
2
2
2
0
2 2
1
1
0
1 1
1 2
=
+ =
+ =
=
Mesure du pH
Pile avec :
-Electrode de rfrence impolarisable : E2
-Electrode de mesure ( hydrogne) dans
une solution de concentration inconnue
T=20C
E(V)= E
2
+ 0,058 pH
Exemple 10
On considre la pile suivante :
Donnes numriques :
T=298K;E
0
(Fe
3+
/Fe
2+
)=0,77V;E
0
(Ag
+
/Ag)=0,80V
1. Calculer la f.e.m E de cette pile
2. Quelle est la relation entre E
0
de la pile et la
constante dquilibre de la raction chimique
lorsque la pile dbite. Calculer cette
constante.
( )
( )
( ) }Ag mol.l 1 , 0 Ag
mol.l 1 , 0 Fe
mol.l 1 , 0 Fe
Pt
1 -
1 - 2
1 - 3
+
+
+
Exemple10
1.Couple Fe
3+
/Fe
2+
: Fe
3+
+ e
-
= Fe
2+
E
1
= E
0
(Fe
3+
/Fe
2+
)+ 0,059 log[Fe
3+
]/[Fe
2+
]
Couple Ag
+
/Ag : Ag
+
+ e
-
= Ag
E
2
= E
0
(Ag
+
/Ag )+ 0,059 log[Ag
+
]
Raction : Ag
+
+ Fe
2+
= Ag + Fe
3+
+ +
+
=
Ag Fe
Fe
K
2
3
Exemple12
( )
K log 059 , 0 E E
V 029 , 0
1 , 0 . 1 , 0
1 , 0
log 059 , 0 77 , 0 80 , 0 E
Ag Fe
Fe
log 059 , 0 ) Fe / Fe ( E ) Ag / Ag ( E E
0
3
2
2 3
0 0
=
= =
=
+ +
+
+ + +
Exemple12
10 10 K : AN
10 K
059 , 0
E E
K log
K log 059 , 0 E E
059 , 0
) 029 , 0 ( 03 , 0
059 , 0
E
0
E
0
0
= =
=
=
=
QCM8
A.Dans une pile lectrochimique en
fonctionnement, la raction qui se produit est
force
B.La loi de Nernst dit que le potentiel pris par
une lectrode trempant dans une solution
dpend : du couple tudi, et des
concentrations (ou des pressions pour les gaz)
des espces intervenant dans le couple
C.Lorsquune pile dbite, la masse de llectrode
positive ne diminue jamais
D.Le pont salin est ncessaire au
fonctionnement de la pile
E.Les ions se dplacent lintrieur des
solutions et du pont salin
QCM9
Donnes:E
0
(H
+
/H
2
)=0V; E
0
(Fe
2+
/Fe)=-0,44V;
; E
0
(Ag
+
/Ag)=0,80V
A 25C, par rapport llectrode normale
dhydrogne
A.Le potentiel dune lame de fer plongeant dans une
solution centimolaire de sulfate de fer vaut -0,38 V
B.Le potentiel de la lame de fer vaut -0,50 V
C.Le potentiel dune lame dargent plongeant dans une
solution de nitrate dargent 10
-3
mol.L
-1
vaut -0,62V
D.Le potentiel de la lame dargent vaut 1,32 V
E.Le potentiel de la lame dargent vaut 0,62 V
QCM10
On ralise la pile suivante : Zn/Zn
2+
//Pb
2+
/Pb
Volume des solutions V=100ml
[Zn
2+
]=5,0.10
-2
mol.L
-1
, [Pb
2+
]= 1,0.10
-2
mol.L
-1
La constante de raction ayant pour ractifs
les ions Zn
2+
et le mtal Pb a pour valeur
K=2.10
-21
.
Un voltmtre est insr dans le circuit
extrieur, sa borne + est relie la lame de
zinc et sa borne la lame de plomb
QCM10
A.Lquation de raction de la pile est :
Pb
2+
+ Zn= Zn
2+
+ Pb
B.Lquation de raction de la pile est :
Zn
2+
+ Pb = Pb
2+
+ Zn
C.La valeur de la tension affiche au voltmtre est
positive
D. lintrieur de la pile, les lectrons se
dplacent de la lame de zinc vers la lame de plomb
E.Quand la pile sarrte de fonctionner, le quotient
de raction a pour valeur Qr=5.
Exemple 13
Solution 1 : Fe (NO
3
)
2
-Electrode en Fer
Solution 2 : Ag(NO
3
) - Electrode en Ag
Solutions relies par un conducteur
Activit de Fe (NO
3
)
2
: a = 2 mol/l
Molarit de Ag(NO
3
) : c = 2 mol/l
ddp mesure entre les 2 solutions : 1241
mv
Coefficient dactivit de Ag
+
?
Exemple 13
2 2 1 2 1
2
2
2
1
1
V 241 , 1 2 log
1
06 , 0
a log
2
06 , 0
E E V
Ag log
Z
06 , 0
E : 2 Solution
Fe log
Z
06 , 0
E : 1 Solution
c
a
C; 27 V 06 , 0
F
RT
= = =
=
=
= =
+
+
Potentiel de diffusion
1 2
A
-
B
+
m
[A
-
]
1
= [A
-
]
2
[B
+
]
1
= [B
+
]
2
Potentiel dquilibre : Equ.
Gibbs-Donnan
1 2
V
2
V
1
- +
A
-
B
+
[A
-
]
1
. [B
+
]
1
= [A
-
]
2
. [B
+
]
2
[A
-
]
1
<
[B
+
]
1
>
[A
-
]
2
[B
+
]
2
Equation de Nernst
) C 27 T (
(mV)
A
A
log
z
60
A
A
Ln
zF
RT
V V
2
1
2
1
2 1
=
=
=
Condition dquilibre
2
1
2
1
2 1
B
B
Ln
F z
RT
A
A
Ln
F z
RT
V V
Exemple14
Solution contenant des ions Cl-
, Na
+
, K
+
, CO
3
H
-
, Ca
++
,
diffusibles travers une
membrane.
Quel est le potentiel quilibre?
Exemple 14
2
3
1
3
2
1
2
1
2
1
2
1
2 1
HCO
HCO
Ln
F
RT
Cl
Cl
Ln
F
RT
Ca
Ca
Ln
F
RT
K
K
Ln
F
RT
Na
Na
Ln
F
RT
V V
+ +
+ +
+
+
+
+
= = =
= =
Exemple 15
On considre 2 compartiments A et B
spars par une membrane permable au K
+
.
Les concentrations en A et B sont
respectivement 0,1M et 0,01M.
1.Calculer la ddp V
A
-V
B
pour laquelle lion K
+
est lquilibre?
2.Pour cette ddp, quelle est la valeur du
flux net de K
+
?
Exemple 15
2. A lquilibre le flux net dions K
+
est
nul.
mV 60 V V
10 log 60
01 , 0
1 , 0
log 60 V V
B A
B A
=
=
|
|
.
|
\
|
=
Exemple 16
On considre 2 compartiments A et B
spars par une membrane permable
contenant HCO
3
-
aux concentrations 1M et
0,1M, respectivement. La ddp entre A et B
est V
A
-V
B
= +100 mV
1.Lion est-il lquilibre ? Satisfait-il
lquation de Nernst?
2.Si lion nest pas lquilibre, dans quel
sens la force lectrochimique va-t-elle le
faire migrer?
Exemple 16
1. Potentiel dquilibre pour lion :
(V
A
-V
B
) eq= +(60)log(1 / 0,1)= +60log10
(V
A
-V
B
) eq= +60 mV
(V
A
-V
B
) eq est diffrent de V
A
-V
B
Pas dquilibre lectrochimique pour
lion
2. z(V
A
-V
B
) <z (V
A
-V
B
) eq : Diff BA
z(V
A
-V
B
) >z (V
A
-V
B
) eq : Diff AB
Flux B A
Macromolcule neutre :
Phnomne de Donnan
Membrane dialysante sparant deux
solutions ioniques de concentrations
diffrentes : dans un des
compartiments se trouve une
macromolcule lectriquement
neutre incapable de traverser la
membrane
Equilibre de Donnan
Etat dquilibre de Donnan
1. Electroneutralit de part et
dautre de la membrane
2. Concentrations ioniques gales
de part et dautre
3. ddp nulle entre les cts de la
membrane
4. Contre pression osmotique lie
la concentration de la
molcule neutre non diffusible
Macromolcule charge :
Phnomne de Donnan
Membrane dialysante sparant
deux solutions ioniques de
concentrations diffrentes: dans
un des compartiments une
macromolcule non diffusible
charge lectriquement ( Ex :
RNa
z
R
z-
+ z Na
+
)
Equilibre de Donnan
t
-
O
-
O+
membrane dialysante
O
-
O
-
O
-
O
-
O
-
O+
O+
O+
O
-
O
-
O
-
O
-
O
-
O
-
Etat final
-
U
Etat initial
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
O+
-
+
Etat dquilibre de Donnan
1.Electroneutralit de part et dautre de la
membrane ( ex : capillaire sanguin, glomrule
rnal )
2.La non galit des concentrations de chaque
ion diffusible ( Prsence macro-ion) de part et
dautre de la membrane
3.ddp non nulle entre les cts de la membrane
4.Pression osmotique plus forte que celle due
au macro-ion ( Pression oncotique>Pression
protines)
Etat dquilibre de Donnan
5.Le macro ion repousse les ions de son
signe de lautre ct de la membrane
6.Le potentiel de Donnan V
2
-V
1
est tel que
le ct de la membrane o est prsent le
macro ion non diffusible se charge de son
signe
Exemple 17
On considre 2 compartiments A et B, de volume
constant, spars par une membrane permable
aux ions K
+
et Cl
-
, mais impermable aux ions Y
-
Compartiment A : [K
+
]
A
= [Y
-
]
A
= 0,1 M
Compartiment B : [K
+
]
B
= [Cl
-
]
B
= 0,1 M
1.En quoi la membrane est-elle de Donnan?
2.Les ions sont-ils lquilibre?
3.A lquilibre, quelles sont les concentrations
des diffrents ions dans chaque
compartiment? Quelle sera la ddp entre A et
B.
Exemple 17
1. Membrane de Donnan, puisqu elle
est permable K
+
, Cl
-
, mais pas
Y
-
.
2. Au dpart lion Cl
-
nest pas
lquilibre. Le flux Cl
-
va de B vers
A (V
A
-V
B
) < 0 Flux K
+
de B
vers A.
Exemple 17
3. A lquilibre : [K
+
]
A
[Cl
-
]
A
= [K
+
]
B
[Cl
-
]
B
( Eq. Gibbs-Donnan) (1)
Electroneutralit[K
+
]
A
= [Cl
-
]
A
+[Y] (2)
[K
+
]
B
= [Cl
-
]
B
(3)
Conservation de la matire
[K
+
]
A
+ [K
+
]
B
= 0,2M (4)
[Cl
-
]
A
+ [Cl
-
]
B
=0,1M (5)
[Y] = 0,1M (6)
Exemple 17
(1) + (3) [K
+
]
A
[Cl
-
]
A
= ([K
+
]
B
)
2
(4) + (5)(0,2- [K
+
]
B
) (0,1- [Cl
-
]
B
)=
([K
+
]
B
)
2
Ou (0,2- [K
+
]
B
) (0,1- [K
+
]
B
)= ([K
+
]
B
)
2
(0,2x0,1)- [K
+
]
B
(0,2+0,1)+ ([K
+
]
B
)
2
=
([K
+
]
B
)
2
(0,2x0,1)= [K
+
]
B
(0,2+0,1)
Exemple 17
[K
+
]
B
=0,02/0,3=0,066M= [Cl
-
]
B
[Cl
-
]
A
=0,033M, [K
+
]
A
=0,133M,
[Y]=0,1M
V
A
-V
B
= -60 log ([K
+
]
A
/ [K
+
]
B
)=-18mV
Exemple 17 :Autre mthode
([K
+
]
A
+x) x=([K
+
]
B
-x)
([Cl
-
]
B
-x)
(0,1+x) x=(0,1
-x)
(0,1
-x)
x
2
+0,1x= x
2
-0,2x+0,01
0,3 x =0,01 x = 0,01/0,3 =0,033 M
x=[Cl
-
]
A
=0,033M,[K
+
]
A
=x+0,1 =0,133M
[Cl
-
]
B
=0,1-0,033=0,066M= [K
+
]
B
QCM11
De part et dautre dune membrane de dialyse, on a,
27C, 2 solutions lquilibre avec :
A.[H
+
]
2
= 10 mmol/L
B.[H
+
]
2
= 4 mmol/L
C.[H
+
]
2
= 8 mmol/L
D.[H
+
]
2
= 2 mmol/L
E.Autre rponse
P
-10
en mmol/L HCO
3
-
en mmol/L H
+
en mmol/L
Solution 1 1,5 ? 16
Solution 2 0 ? ?
QCM12
La diffrence de potentiel (V
1
-V
2
) de part
et dautre de la membrane vaut :
A.-24 mV
B.-18 mV
C.-10,5 mV
D.-36 mV
E.Autre rponse
QCM13
Soit une cellule excitable avec les donnes suivantes :
Parmi les rponses proposes
A.-89 mV
B.-78 mV
C.-65 mV
D.50 mV
E.78mV
Concentration (mEq/L) Intracellulaire Extracellulaire
Na
+
36 240
K
+
210 7
Cl
-
15 300
QCM13
Choisir celle qui correspond 27C:
1. Au potentiel de repos
2. Au potentiel daction
3. Au post-potentiel
4. Au potentiel dquilibre des ions K
+
QCM13
| |
| |
| |
| |
| |
| |
mV 50
36
240
log 60
Na
Na
log 60 U
mV 89
210
7
log 60
K
K
log 60 U
mV 78
300
15
log 60
Cl
Cl
log 60 U
i
e
Na
i
e
K
e
i
Cl
= = =
= = =
= = =
+
+
+
+
QCM13
Potentiel de repos = -78 mV
Potentiel daction = 50 mV
Post potentiel = -89 mV
Potentiel dquilibre des ions K
+
= -89 mV
Dfinition
On appelle diagramme de
Davenport les graphes
donnant lvolution des ions
carbonate HCO
3
-
(aq) en
fonction du pH de lorganisme
Lois de variation de
[HCO
3
-
]
constante b
.pH L mmol. 25
DE) la de pente ou ( ferms systmes des tampon pouvoir
pH
HCO
CO du (DE) ion quilibrat d' droites de Famille : b pH . HCO
: varie P Si
isobares courbes de Famille : 10 . P . 03 , 0 HCO
: constante maintenue est P Si
poumons les dans CO en partielle pression P
1 - 1 -
-
3
2
-
3
2
CO
6,1 - pH
2
CO
-
3
2
CO
2
2
CO
=
=
=
A
A
= |
+ | =
-
=
-
=
Dfinitions
On appelle point normal, le point N
reprsentant un tat acido-basique normal
soit [HCO
3
-
]=24 mmol.L
-1
et pH=7,40.
Lisobare passant par le point normal est
appel isobare normale.
La droite normale dquilibration (DNE)
correspond la droite dquilibration
passant par N.
Isobares et droites
dquilibration
pH
P
CO2
mmHg
N
[HCO
3
-
]
mmol/L
40
<40
>40
24
7,4
DNE
Isobare
normale
v
i
- v
e
(mV)
0
~ - 78
~ - 89
Post
Potentiel
t
t
Potentiel
de repos
Stimulation
Permabilit
~ 50 ms
P
Na+
P
K+
U
Cl
~ +50
U
Na
U
K
Potentiel
daction
Activit lectrique
de la cellule
Mcanismes de compensation
pH
N
[HCO
3
-
]
mmol/L
24
7,4
Acidose Alcalose
I
III
II
IV
I et III : compensation
II et IV : double agression
mtabolique et respiratoire
.M
1
. M
2
.P
1
P
2
.
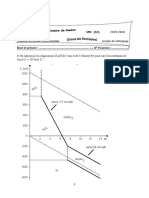
Exemple 18
Placer sur le diagramme de Davenport le point
reprsentatif dun sujet:
A atteint dune acidose respiratoire non
compense
B atteint dune alcalose mtabolique non
compense
C atteint dune alcalose respiratoire partiellement
compense
D atteint dune acidose mixte avec [HCO
3
-
] normal
E atteint dune agression totalement compense
par perfusion de bicarbonates
Exemple 18
pH
N
[HCO
3
-
]
mmol/L
24
7,4
.A
.B
.C
.D
.E
Exemple 19
Soit le LEC dun sujet avec un pH de 7,4,
[HCO
3
-
]=28 mmol.L
-1
, [CO
2
]=1,4 mmol.L
-1
Loi dHenderson-Hasselbach :
pH= 6,1 + log 20 = 7,4
1.Si on ajoute 14 mmol de HCl par litre de
LEC : en absence de tampon carbonique ou
autres 14 mEq/L de H
+
pH =1,85
Exemple 19
2. Avec tampon carbonique :
HCO
3
-
+ H
+
CO
2
+ H
2
O
[HCO
3
-
] =28-14 = 14 mEq/L
[CO
2
]=1,4 + 14 = 15,4 mEq/L
pH = 6,1 + log 14/15,4 = 6,06
->[H
+
] 15000 fois plus faible que sans
tampon
Avec les autres tampons : pH >6,06
Exemple 19
3.[CO
2
] tend rester en quilibre avec la P
CO2
.
Si P
CO2
= Cte = 40 mmHg --> CO
2
limin et
revient 1,4 mmol/L
pH= 6,1 + log 14/1,4 = 7,1
4.Intervention du systme respiratoire pour
lhypercapnie -> P
CO2
passe
23 mmHg [CO
2
]
=0,6 mmol/L
pH= 6,1 + log 14 / 0,7 = 7,4
5.Le rein va finalement liminer les 14 mmol en
excs, et rgnrer les bicarbonates et
ramener [HCO
3
-
] sa valeur initiale , la
ventilation diminue et PCO
2
revient 40 mmHg.
Forces intermolculaires
Force dinteraction
molculaire
Energie de surface
W= S
( >0)
Energie de cohsion
Cest le travail fournir
pour vaincre les forces de
cohsion
Exemple 1
Quel travail faut-il fournir ?
1.Pour casser un bton de craie de section
S en deux morceaux,
cr
tant la tension
superficielle de la craie
2.Pour pulvriser une goutte deau de
surface S en n gouttelettes de surface s.
On donne
E
de leau.
Exemple 1
1. Deux surfaces S sont nouvellement
cres
Wc = 2
cr
. S
2. Surface initiale = S
i
Surface finale = S
f
= n.s
Wc =
E
(S
f
- S
i
)
Energie dadhsion
Cest le travail fournir pour sparer deux
phases ( liquide-solide par exemple) de
surface S
Wa = (
L
+
S
L/S
) S
L
= Cte tension superficielle du liquide
S
= Cte tension superficielle du solide
L/S
= Cte tension superficielle du mlange
liquide-solide
Potentiel dlectrode
Mtal plong dans une solution contenant
lun de ses sels
Potentiel dlectrode
Ex : Fe (NO3)2 et une lectrode en Fer
Ag(NO3) et une lectrode en Ag
(
+
+ M ln
zF
RT
0
EM
Formule du potentiel
dlectrode : Loi de Nernst
Zn
Zn++
1
2
ZnSO
4
2e
-
Zn Zn
++
Mtal
Solution
EM= Vmt-Vsol =
EM0= Potentiel
Normal
Zn/Zn++=-0,76
Mesure de ddp
ddp =V
M
-V
N
= E
M
-E
N
M
M
+
N
N
+
Pont de KCl
concentr
Exemple 9
Solution 1 : Fe (NO
3
)
2
-Electrode en Fer
Solution 2 : Ag(NO
3
) - Electrode en Ag
Solutions relies par un conducteur
Activit de Fe (NO
3
)
2
: a = 2 mol/l
Molarit de Ag(NO
3
) : c = 2 mol/l
ddp mesure entre les 2 solutions : 1241
mv
Coefficient dactivit de Ag
+
?
Exemple 9
2 2 1 2 1
2
2
2
1
1
V 241 , 1 2 log
1
06 , 0
a log
2
06 , 0
E E V
Ag log
Z
06 , 0
E : 2 Solution
Fe log
Z
06 , 0
E : 1 Solution
c
a
C; 27 V 06 , 0
F
RT
= = =
=
=
= =
+
+
QCM2
La mobilit dun ion dans un champ
lectrique:
A. est fonction de la ddp lectrique
B. dpend de la concentration
C. est la base de lanalyse par
lectrophorse
D. est fonction de la charge de lion
E. est sa vitesse de migration
Rponses QCM2
La mobilit dun ion dans un champ
lectrique:
A.
B. dpend de la concentration
C. est la base de lanalyse par
lectrophorse
D. est fonction de la charge de lion
E.
QCM3
A.Un cristal de glace fond dans de leau pure
0C mais il ne fond pas dans une solution 0C
B.Dans ce phnomne linterface glace-liquide
joue le rle de la membrane hmipermable
C. Osmomtrie et cryoscopie sont de mme
nature mais ont des domaines dapplications
diffrents
D.Une solution de NaCl dcimolaire 27C
dveloppe une pression osmotique quivalente de
5m H
2
O et un AT de 0,37C
E.Le AT cryoscopique du plasma est de 0,56C
Rponses QCM3
A.
B.Dans ce phnomne linterface glace-liquide
joue le rle de la membrane hmipermable
C. Osmomtrie et cryoscopie sont de mme
nature mais ont des domaines dapplications
diffrents
D.
E.Le AT cryoscopique du plasma est de 0,56C
QCM4
Les dosages sanguins d'un patient donnent les
rsultats suivants en mmol/l : Ure = 3.5.
Magnsium=1; Sodium=142; Chlore=103.
Potassium=5.4; Protines=3; Glucose=3.8;
Calcium=1.9.
A. Si la masse molaire du glucose est de 180 g, on
peut en dduire une glycmie de 684 g/l
B. Cq(Ca++)=3.8 mEq/l
C. L'osmolarit relle peut se mesurer par la
mthode du A cryoscopique
D. Ceq(Na+)=142 Eq/l
E. Les donnes ci-dessus nous permettent d'avoir une
estimation de l'osmolarit de l'ordre de 296.7
mosm.
Rponses QCM4
Les dosages sanguins d'un patient donnent les
rsultats suivants en mmol/l : Ure = 3.5.
Magnsium=1; Sodium=142; Chlore=103.
Potassium=5.4; Protines=3; Glucose=3.8;
Calcium=1.9.
A.
B.Cq(Ca++)=3.8 mEq/l
C.L'osmolarit relle peut se mesurer par la
mthode du A cryoscopique
D.
E.Les donnes ci-dessus nous permettent
d'avoir une estimation de l'osmolarit de
l'ordre de 296.7 mosm.
QCM5
Chez un sujet normal, suite une restriction
de la dite hydrique, on observe une
augmentation de 10 mEq/l de la
concentration plasmatique de lion Na+; les
autres modifications cationiques peuvent
tre considres comme ngligeables, le
cation principal tant lion sodium. Quelle est
laugmentation associe de losmolarit
plasmatique (en mOsm/l)?
A. 0,06 B. 0,5 C. 1,5 D. 10 E. 20
Rponses QCM5
Chez un sujet normal, suite une restriction
de la dite hydrique, on observe une
augmentation de 10 mEq/l de la
concentration plasmatique de lion Na+; les
autres modifications cationiques peuvent
tre considres comme ngligeables, le
cation principal tant lion sodium. Quelle est
laugmentation associe de losmolarit
plasmatique (en mOsm/l)?
A. B. C. D. E. 20
QCM6 (suite QCM5)
Le delta cryoscopique du plasma lu au 1/100
de degr sen trouve:
A. rduit de 0,56C
B. rduit de 0,04C
C. rduit de 0, 02C
D. accru de 0,04C
E. accru de 1,86C
Rponses QCM6
Le delta cryoscopique du plasma lu au 1/100
de degr sen trouve:
A.
B.
C.
D. accru de 0,04C
E.
QCM7 (suite QCM5)
La correction de cette anomalie pourra se
faire par :
A. une volution vers lhypernatrmie
B. une sortie deau plasmatique vers lespace
interstitiel
C.une hypervolmie partir de leau
interstitielle
D. une fuite de protines plasmatiques vers le
secteur extravasculaire
E. une hyperhydratation intracellulaire
Rponses QCM7 (suite QCM5)
La correction de cette anomalie pourra se
faire par :
A.
B.
C.une hypervolmie partir de leau
interstitielle
D.
E.
QCM8
Concernant la mobilit dun ion soumis laction
dun champ lectrique
A. Elle est indpendante de la viscosit du milieu
B. Elle est toujours identique pour deux ions de
mme charge
C. Elle dpend de lintensit du champ lectrique
D. Elle seffectue toujours vitesse croissante
E. Elle gnre une force de frottement
QCM9
La technique dlectrophorse
A. Ne peut sappliquer qu des molcules
neutres sans charge lectrique
B. Ncessite lapplication dun champ
lectrique
C. Permet lanalyse des protines plasmatiques
D. Spare les molcules en fonction de leur
solubilit dans les lipides
E. Peut entraner un dplacement dans
lalbumine plasmatique
QCM10
La prsence dun macro ion non diffusible dun
ct dune membrane de dialyse
A. Est responsable dun phnomne dosmose
B. Nempche pas lhomognisation des
concentrations en ions diffusibles
C. Entrane lapparition dune ddp rapidement
rsolutive
D. Aboutit lquilibre de Donnan
E. Constitue une situation que lon observe in
vivo au niveau de la membrane capillaire
Exemple 4
On ralise llectrophorse sur papier dune
solution de 2 protines A et B. Une goutte de
solution dpose sur la ligne de dpart
dtermine une tache de diamtre d=5 mm. Les
conditions exprimentales sont U=100V;
distance entre les lectrodes : l=10cm; mobilits
lectrophortiques :U
A
=4,5.10
-7
SI; U
B
=5,5.10
-
7
SI.
Au bout de combien de temps et quelle
distance du point de dpart peut-on considrer
que les deux protines sont spares?Que se
passe t-il si la diffusion nest plus ngligeable?
Exemple 4
Les distances parcourues par A et B au bout dun
temps t :
l
A
= v
A
.t = u
A
.E.t et l
B
= v
B
.t = u
B
.E.t
soit
l
A
= u
A
.E.t
0
= 2,25 cm ; l
B
= u
B
.E.t
0
= 2,75 cm
Si la diffusion nest plus ngligeable , elle augmente le
diamtre de la tache au cours de sa migration, le temps
pour sparer A et B est plus long (intrt de la petite
taille de la tache)
( )
( )
sec 50
l
U
E
0
0
=
=
=
=
B A
B A
u u U
dl
t soit
u u E
d
t
QCM11
Concernant la membrane cellulaire :
A. Elle est permable au sodium
B. Elle a une face interne lectrongative
C. Elle a une face externe lectropositive
D. Elle est impermable leau
E. Elle est le sige de mcanismes de
transport actif
QCM12
Lquation de Nernst :
A. Donne la ddp transmembranaire
B. Concerne lquilibre ionique
C. Est vrifie si le courant de filtration
compense le courant de migration
D. Donne la ddp qui annule le courant pour
un ion donn
E. Sapplique au phnomne de Donnan
QCM13
Une membrane dialysante spare deux solutions
lectrolytiques de concentration ingale, dans lun
des compartiments se trouve une macromolcule
neutre, ltat dquilibre est tel que :
A.Llectroneutralit de part et dautre de la
membrane
B.Lgalit des concentrations de chaque ion de
part et dautre
C.Lexistence dun potentiel de diffusion entre les
cts de la membrane
D.Ltablissement dune contre-pression osmotique
E.Identique la membrane du glomrule rnal
QCM13
Lquilibre de Donnan :
A. Est d la prsence dun ion non diffusible
B. Entrane une pression suprieure celle
prvue par la loi de Vant Hoff
C. Entrane une galisation de la concentration
des ions non diffusibles
D. Entrane une ddp de part et dautre de la
membrane
E. Est d la prsence dune molcule neutre non
diffusible
+
-
K
+
155 mEq/l
4 mEq/l
+
-
Na
+
12 mEq/l
145 mEq/l
+
-
Cl
-
4 mEq/l
120 mEq/l
D
M
ddp
eq
= +65 mV
ddp
eq
= -90 mV
ddp
eq
= -95 mV
Membrane
cellulaire
QCM14
Concernant une membrane de Donnan :
A. Pour supprimer leffet Donnan il suffit de
travailler au pH isolectrique pH
i
du macro-ion
B. On peut rendre leffet ngligeable si on dialyse
le macro-ion contre une solution trs concentre
dlectrolyte
C. Leffet Donnan diminue avec le rapport de
Donnan
D. La pression osmotique due leffet Donnan est
maximale si le macro-ion est oppos de leau
pure
E. Lorsque le pH de la solution est infrieure au pHi
la protine est charge ngativement
QCM15
Concernant la membrane cellulaire les
concentrations ioniques EC et IC en mEq/l sont :
[Na
+
]
e
=140, [K
+
]
e
=4, [Cl
-
]
e
=120
[Na
+
]
i
=12, [K
+
]
i
=155, [Cl
-
]
i
=4
A.Na
+
tend fortement rentrer dans la cellule
B.K
+
tend sortir de la cellule
C.Cl
-
est lquilibre
D.La permabilit de Na
+
est environ 50 fois celle
de K
+
E.La constance observe des concentrations
ioniques EC et IC sexplique par le transport actif
des ions.
QCM15
Concernant la membrane cellulaire les
concentrations ioniques EC et IC en mEq/l sont :
[Na
+
]
e
=140, [K
+
]
e
=4, [Cl
-
]
e
=120
[Na
+
]
i
=12, [K
+
]
i
=155, [Cl
-
]
i
=4
A.Na
+
tend fortement rentrer dans la cellule
B.K
+
tend sortir de la cellule
C.Cl
-
est lquilibre
D.La permabilit de Na
+
est environ 50 fois celle
de K
+
E.La constance observe des concentrations
ioniques EC et IC sexplique par le transport actif
des ions.
Effet Donnan
QCM13
Une membrane cellulaire au repos, 37C, spare 2
milieux dans lesquels les concentrations ioniques sont
les suivantes:
Intra : [Na
+
]
i
= 12 mmol/L; [K
+
]
i
=150 mmol/L
Extra:[Na
+
]
e
=140 mmol/L; [K
+
]
e
=6 mmol/L
Le potentiel de repos est gal -78,8 mV.
Le rapport des mobilits u
K
/u
Na
est de lordre de:
A.40
B.50
C.60
D.70
E.Autre rponse
QCM13 suite
A un instant du potentiel daction, la cellule tant
en cours dactivit, le rapport des mobilits
devient u
K
/u
Na
= 20 ( les concentrations sont
considres inchanges). La valeur du potentiel
de membrane est de lordre de :
A.+70,5 mV
B.+59,7 mV
C.+52,7 mV
D.+48,9 mV
E.Autre rponse
Вам также может понравиться
- 1 Cours Physico Chimie Des Électrolytes 2013Документ31 страница1 Cours Physico Chimie Des Électrolytes 2013aouОценок пока нет
- Td2 Biophysique SNV UstombДокумент1 страницаTd2 Biophysique SNV UstombChenouza SghrОценок пока нет
- Électrochimie Chap-1Документ17 страницÉlectrochimie Chap-1Zineb SassiОценок пока нет
- S2 Fi Gmqe Chimiedeselectrolytesp1 CM PDFДокумент78 страницS2 Fi Gmqe Chimiedeselectrolytesp1 CM PDFSaad ElfalahОценок пока нет
- Chimie Des Electrolytes CompressedДокумент31 страницаChimie Des Electrolytes CompressedDjemil HalimaОценок пока нет
- Chap1 Rappel Sur Les Solutions ÉlectrolytiquesДокумент9 страницChap1 Rappel Sur Les Solutions Électrolytiquesemma VОценок пока нет
- Solutions Elecrolytiques - 1Документ4 страницыSolutions Elecrolytiques - 1bagabiОценок пока нет
- Définition Conductivité ÉlectriqueДокумент41 страницаDéfinition Conductivité ÉlectriqueBrian WalkerОценок пока нет
- Chapitre 1 CONDUCTIVITEДокумент53 страницыChapitre 1 CONDUCTIVITENina MerwaОценок пока нет
- Chapitre 2 Conductibilité Des IonsДокумент15 страницChapitre 2 Conductibilité Des IonsLinda KoundziОценок пока нет
- Cours BiophysiqueДокумент55 страницCours BiophysiqueLionel DaheОценок пока нет
- 1 ConductimetrieДокумент10 страниц1 Conductimetrieqal123Оценок пока нет
- Wa0024Документ7 страницWa0024CARDI BОценок пока нет
- Conductimetrie TP 2 PDFДокумент16 страницConductimetrie TP 2 PDFMikel Carter83% (6)
- Biophysique Solutions ÉlectrolytiquesДокумент15 страницBiophysique Solutions ÉlectrolytiquesNabil holmes100% (3)
- Cours Réda 4Документ30 страницCours Réda 4Yassine KouraneОценок пока нет
- Biophysique 3Документ8 страницBiophysique 3abdirahman abdillahiОценок пока нет
- TP ÉlectrolyteДокумент17 страницTP Électrolytesamir nafaiОценок пока нет
- 2 - ConductimetrieДокумент6 страниц2 - Conductimetrieanie KheliliОценок пока нет
- TD 2 BiophyДокумент2 страницыTD 2 BiophyDav MotjolopaneОценок пока нет
- Nouveau Document Microsoft WordДокумент8 страницNouveau Document Microsoft Wordla physique selon le programme FrançaisОценок пока нет
- Electrochimie-Chapitre 1-R-KIHALДокумент15 страницElectrochimie-Chapitre 1-R-KIHALManar Smith100% (1)
- Titrages ConductimétriquesДокумент3 страницыTitrages ConductimétriquesamineshoyoОценок пока нет
- CHAPITRE I Rappels Sur Les Solution Éléctrolytiques-ConvertiДокумент7 страницCHAPITRE I Rappels Sur Les Solution Éléctrolytiques-ConvertiAbderahimОценок пока нет
- Cours Electrochimie l3gpДокумент36 страницCours Electrochimie l3gpidouiОценок пока нет
- Cours D ElectrochimieДокумент35 страницCours D ElectrochimieAdel LaimecheОценок пока нет
- Cours de Chimie Des Solutions-2Документ10 страницCours de Chimie Des Solutions-2Zakaria BbaОценок пока нет
- Compte Rendu Du TP N°1 Electrochimie: Conductivité en Solution AqueuseДокумент7 страницCompte Rendu Du TP N°1 Electrochimie: Conductivité en Solution AqueuseHadil Guimer50% (6)
- Chapitre 1Документ42 страницыChapitre 1Mohamed meОценок пока нет
- Chimie Chapitre4 ConductimetrieДокумент4 страницыChimie Chapitre4 ConductimetrieSamira ElAllaouiОценок пока нет
- Chapitre IДокумент9 страницChapitre IŠãnFÖo Gh'aaОценок пока нет
- Chapitre5 Mobilite-Nombres de TransportДокумент25 страницChapitre5 Mobilite-Nombres de TransportRoland Agasro100% (1)
- Chapitre 3 Propriétés Électriques Des SolutionsДокумент6 страницChapitre 3 Propriétés Électriques Des SolutionsChai Maa100% (1)
- Cours D'electrochimie 1-ConvertiДокумент13 страницCours D'electrochimie 1-ConvertiMarwa HociniОценок пока нет
- TD 2electroДокумент1 страницаTD 2electroidoui100% (1)
- TP ElectrochromieДокумент17 страницTP Electrochromie123456789Оценок пока нет
- Cours C5 Mesure de La ConductiviteДокумент6 страницCours C5 Mesure de La ConductiviteSHOUBAKIОценок пока нет
- Conductimetrie - TPДокумент18 страницConductimetrie - TPChafi Mohammed100% (1)
- Biophysique2an-Proprietes Solutions MoleculairesДокумент7 страницBiophysique2an-Proprietes Solutions MoleculairesChihebОценок пока нет
- Cours D'électrochimie 2021-2022Документ27 страницCours D'électrochimie 2021-2022Aliouat Roumaissa100% (1)
- Fascicule TP2012-13Документ58 страницFascicule TP2012-13Moustapha BelmoudenОценок пока нет
- TD ECC+CRG - Semestre05 - L3Документ21 страницаTD ECC+CRG - Semestre05 - L3luckfi binadsОценок пока нет
- Chapitre C3 ConductimetrieДокумент5 страницChapitre C3 ConductimetrieLahcen Ben SalmОценок пока нет
- Chapitre C3 Conductimetrie PDFДокумент5 страницChapitre C3 Conductimetrie PDFMANSOURIОценок пока нет
- Chapitre C3 ConductimetrieДокумент5 страницChapitre C3 ConductimetrieMANSOURIОценок пока нет
- La Conductance Et La ConductiviteДокумент5 страницLa Conductance Et La Conductivitemohamed laghrib100% (1)
- Conductimetrie Rappels CoursДокумент11 страницConductimetrie Rappels CoursAmanda BellОценок пока нет
- Chimie Analytique - (Chap 3)Документ14 страницChimie Analytique - (Chap 3)Omar AbdelkefiОценок пока нет
- CoursДокумент29 страницCoursalamranimalika7Оценок пока нет
- TDEEG0304Документ9 страницTDEEG0304Prince Abdoo100% (2)
- TP Conductimétrie - New1Документ9 страницTP Conductimétrie - New1Wahiba Abdoun0% (1)
- Mesure Des Quantites de Matiere en Solution Par Conductimetrie Exercices Non Corriges 1Документ4 страницыMesure Des Quantites de Matiere en Solution Par Conductimetrie Exercices Non Corriges 1Jose YoussefОценок пока нет
- Chapitre 2Документ25 страницChapitre 2chaymae.bikhОценок пока нет
- 09 - Transports Electriques Et TransmembranairesДокумент10 страниц09 - Transports Electriques Et Transmembranairessisics2005Оценок пока нет
- Cours & Exercices Mesure de Quantités de Matière Par ConductimétrieДокумент6 страницCours & Exercices Mesure de Quantités de Matière Par ConductimétrieAmine AlaoUii AlaouiОценок пока нет
- Correction Epreuve de Chimie Des Electrolytes 2013 2014Документ5 страницCorrection Epreuve de Chimie Des Electrolytes 2013 2014Abdelhakim BailalОценок пока нет
- SMC S3 Chim Exp Norm 2021Документ2 страницыSMC S3 Chim Exp Norm 2021Abdelhakim BailalОценок пока нет
- Correction Epreuve de Chimie Des Electrolytes 2014 20152Документ5 страницCorrection Epreuve de Chimie Des Electrolytes 2014 20152Abdelhakim BailalОценок пока нет
- CHP 1 2023Документ14 страницCHP 1 2023Abdelhakim BailalОценок пока нет
- SMC s3 Ratt 2017Документ8 страницSMC s3 Ratt 2017Abdelhakim BailalОценок пока нет
- Série 1 s5 20Документ9 страницSérie 1 s5 20Abdelhakim BailalОценок пока нет
- SMPC S1 Série 2 2021Документ11 страницSMPC S1 Série 2 2021Abdelhakim BailalОценок пока нет
- ChmTheo S5 Chap3 PDFДокумент24 страницыChmTheo S5 Chap3 PDFAbdelhakim BailalОценок пока нет
- Corr Serie 3 Prob SMC s4 - CompressedДокумент4 страницыCorr Serie 3 Prob SMC s4 - CompressedAbdelhakim BailalОценок пока нет
- Chapitre IIДокумент48 страницChapitre IIAbdelhakim Bailal100% (1)
- SMPC s1chp IV 2020Документ40 страницSMPC s1chp IV 2020Abdelhakim Bailal100% (1)
- SMPC S2 CHP 1 Chimie Des Solutions 21Документ15 страницSMPC S2 CHP 1 Chimie Des Solutions 21Abdelhakim BailalОценок пока нет
- DM 5 Option PCДокумент8 страницDM 5 Option PCAbdelhakim BailalОценок пока нет
- SMPC s2 CHP 2Документ31 страницаSMPC s2 CHP 2Abdelhakim BailalОценок пока нет
- SMC S3 Ratt 2021Документ7 страницSMC S3 Ratt 2021Abdelhakim BailalОценок пока нет
- SMPC 2020 RattДокумент3 страницыSMPC 2020 RattAbdelhakim BailalОценок пока нет
- Master CHP 4 Corrosion 2021Документ31 страницаMaster CHP 4 Corrosion 2021Abdelhakim BailalОценок пока нет
- ChmTheo S5 Chap1Документ12 страницChmTheo S5 Chap1Abdelhakim Bailal100% (2)
- Energie Réticulaire PDFДокумент1 страницаEnergie Réticulaire PDFAbdelhakim BailalОценок пока нет
- ChmTheo S5 Chap3 PDFДокумент24 страницыChmTheo S5 Chap3 PDFAbdelhakim BailalОценок пока нет
- Biochimie ElectrodesДокумент12 страницBiochimie ElectrodesAbdelhakim Bailal100% (2)
- SMPC S2 Exam 2016Документ4 страницыSMPC S2 Exam 2016Abdelhakim BailalОценок пока нет
- Energie RéticulaireДокумент1 страницаEnergie RéticulaireAbdelhakim Bailal0% (1)
- ChmTheo S5 Chapitre 7Документ32 страницыChmTheo S5 Chapitre 7Abdelhakim BailalОценок пока нет
- SMC S3 Chim Exp Ratt 2020 PDFДокумент2 страницыSMC S3 Chim Exp Ratt 2020 PDFAbdelhakim BailalОценок пока нет
- Chromatographie Op PDFДокумент41 страницаChromatographie Op PDFAbdelhakim BailalОценок пока нет
- Acide Base PDFДокумент3 страницыAcide Base PDFAbdelhakim BailalОценок пока нет
- Série 4 19Документ9 страницSérie 4 19Abdelhakim BailalОценок пока нет
- Chapitre 14 Diagramme e PHДокумент9 страницChapitre 14 Diagramme e PHAbdelhakim BailalОценок пока нет
- SMPC Exm CH - Sol 2015Документ4 страницыSMPC Exm CH - Sol 2015Abdelhakim BailalОценок пока нет
- 1ère D - PHYSIQUE SEQ N°03 2010 - 2011Документ2 страницы1ère D - PHYSIQUE SEQ N°03 2010 - 2011Boris NguetaОценок пока нет
- PHY108 Séance 3Документ2 страницыPHY108 Séance 3Gayo EntrepreneurОценок пока нет
- TC Maroc - Tube SS T10Документ1 страницаTC Maroc - Tube SS T10Ilyass ZerrikОценок пока нет
- Thèse: Thème Etude Du Mécanisme Et de La Cinétique de Précipitations Dans L'alliage (MG - Al)Документ135 страницThèse: Thème Etude Du Mécanisme Et de La Cinétique de Précipitations Dans L'alliage (MG - Al)Hamza OuterzaОценок пока нет
- IEER2016 CC3 Corrigé 16102016Документ1 страницаIEER2016 CC3 Corrigé 16102016Jul-Bubing TechniqueОценок пока нет
- Influence de La TempératureДокумент2 страницыInfluence de La TempératureValentin PetelatОценок пока нет
- 28408Документ443 страницы28408vesipkaОценок пока нет
- Vibrations Et Ondes Chapitre Ii 2021 2022Документ10 страницVibrations Et Ondes Chapitre Ii 2021 2022hadil medОценок пока нет
- Calcul D'escalierДокумент12 страницCalcul D'escalierMalekMsakniОценок пока нет
- COCAS SujetДокумент6 страницCOCAS SujetNữ TốОценок пока нет
- Trés Important Pour Mecaniques FluidesДокумент110 страницTrés Important Pour Mecaniques FluidesedrissiadnaneОценок пока нет
- ArchimedeДокумент4 страницыArchimedeHad JerОценок пока нет
- ENPC BAEP1 2011 - SEANCE 6 Mode de CompatibiliteДокумент30 страницENPC BAEP1 2011 - SEANCE 6 Mode de Compatibiliteaymen3333100% (1)
- M1165 PDFДокумент12 страницM1165 PDFMohamedОценок пока нет
- Série 3 ThermoДокумент1 страницаSérie 3 Thermoyasser chaouakОценок пока нет
- Base Des Faisceaux HertziensДокумент59 страницBase Des Faisceaux HertziensMartin100% (2)
- TD Thermodynamique - Série N°1 - 2017-2018Документ2 страницыTD Thermodynamique - Série N°1 - 2017-2018Samiya CОценок пока нет
- Se - Rie 1 Transfert Avec SolutionДокумент13 страницSe - Rie 1 Transfert Avec Solutionchakib abОценок пока нет
- Deo1 Stat Nav s04Документ2 страницыDeo1 Stat Nav s04Elmalik FALLОценок пока нет
- CVG2540 - Final 2022 - 6Документ8 страницCVG2540 - Final 2022 - 6Amen SheikhОценок пока нет
- TD Série N3 + CorrectionДокумент6 страницTD Série N3 + Correctionismailmoudziri7Оценок пока нет
- PliageДокумент5 страницPliageAbderrazak ZahirОценок пока нет
- Corrigé TD-6 - Assemblages BoulonnésДокумент14 страницCorrigé TD-6 - Assemblages BoulonnésTenacious DemonОценок пока нет
- Tle Partie IДокумент20 страницTle Partie ISALEH MISKINОценок пока нет
- Projet de Béton Précontraint-1Документ31 страницаProjet de Béton Précontraint-1Latif SemdeОценок пока нет
- Etude Et Maintenance Du Circuit Hydraulique de La Rouleuse Croqueuse PICOTtype RCS PDFДокумент151 страницаEtude Et Maintenance Du Circuit Hydraulique de La Rouleuse Croqueuse PICOTtype RCS PDFOthman0% (1)
- Perte de Charge HydrauliqueДокумент22 страницыPerte de Charge HydrauliqueHammadi Ibtissame100% (2)
- Cours Model Edurmat 1Документ72 страницыCours Model Edurmat 1Enid EdaasОценок пока нет
- Chapitre IV LélectrodialyseДокумент7 страницChapitre IV LélectrodialyseFousseyni TRAOREОценок пока нет
- Sciences Industrielles Pour L'Ingénieur I: CompacteurДокумент18 страницSciences Industrielles Pour L'Ingénieur I: CompacteurHamid ArarbyОценок пока нет