Академический Документы
Профессиональный Документы
Культура Документы
Teorii Immuniteta. Immunologicheskaya Pamyat. Immunologicheskaya Tolerantnost. Regulyatsiya Immuniteta.
Загружено:
bagdauletamangeldi1Авторское право
Доступные форматы
Поделиться этим документом
Поделиться или встроить документ
Этот документ был вам полезен?
Это неприемлемый материал?
Пожаловаться на этот документАвторское право:
Доступные форматы
Teorii Immuniteta. Immunologicheskaya Pamyat. Immunologicheskaya Tolerantnost. Regulyatsiya Immuniteta.
Загружено:
bagdauletamangeldi1Авторское право:
Доступные форматы
1
ЛЕКЦИЯ 7
ТЕМА:Теории иммунитета. Иммунологическая память.
Иммунологическая толерантность. Регуляция иммунитета
ТЕОРИИ ИММУНИТЕТА
Выявление роли патогенных микроорганизмов в развитии инфекционных
болезней, возможность искусственного создания невосприимчивости
подтолкнули к изучению фактов защиты организма от инфекционных агентов уже
в конце 19 в.
Л.Пастер предложил теорию «исчерпанной силой»; согласно этой теории
«невосприимчивость» представляет состояние, при котором организм человека
(как питательная среда) не поддерживает развитие микробов. Конечно, эта теория
не выдерживала критики.
Теории иммунитета – это совокупность научных идей и экспериментальных
данных, объясняющих механизм развития иммунного ответа, характерные для
определенного исторического периода.
2
Первыми попытками в этой области, одобренными, в конце концов,
современниками, считаются фагоцитарная теория И.И.Мечникова и гуморальная
теория П.Эрлиха.
В 1883 г. И. Мечников, изучая, как зоолог, морских беспозвоночных фауны
Черного моря в Одессе, обнаружил сходство внутриклеточного переваривания у
амеб, клеток энтодермы кишечнополостных и некоторых клеток мезенхимного
происхождения высших организмов (моноцитов крови, тканевых макрофагов).
Эти процессы наблюдали и до Мечникова другие микроскописты. Но только
Мечников осознал, что это явление не есть процесс питания данной единичной
клетки, а есть защитный процесс в интересах целого организма.
Против теории Мечникова в начале 20-го века было большинство патологов,
т.к. они наблюдали фагоцитоз в очаге воспаления (т.е. в пораженных тканях) и
считали лейкоциты (гной) болезнетворными, а не защитными клетками. Более
того, некоторые указывали, что фагоциты – разносчики бактерий по организму,
ответственные за диссеминацию инфекций.
Мечников первым рассматривал воспаление как защитное, а не
разрушительное явление. Мечников назвал описанные им защитные клетки
«пожирающими клетками». Его молодые французские коллеги предложили
использовать греческие корни: от греч. phagos, поедать + kytos, клетка. Мечников
3
принял этот вариант, и появился термин «фагоциты». Позднее (1901) он доказал
роль фагоцитирующих клеток в элиминации патогенов и предложил
фагоцитарную (клеточную) теорию иммунитета. Теория Мечникова чрезвычайно
понравилась Л. Пастеру, и он пригласил И.И. работать в свой институт в Париже.
Критику фагоцитарной теории начал Г.Н.Габричевский, доказавший, что
решающую роль в элиминации возбудителя возвратной лихорадки играет
сыворотка крови, а не фагоциты.
В дальнейшем Пауль Эрлих предложил одну из первых теорий
антителообразования. Он назвал противомикробные вещества крови термином
«антитело», т.к. бактерии в то время называли «korper» - микроскопические
тельца. Эрлих предположил, что у клеток имеются антигенспецифические
рецепторы, которые под действием АГ освобождаются в качестве АТ. И хотя в те
времена факты свидетельствовали, что в крови неконтактировавшего с
конкретным возбудителем макроорганизма не обнаруживают специфические АТ
против данного микроба, Эрлих сумел предугадать, что и до контакта с
возбудителем в организме уже существуют специфические АТ в виде, который он
назвал «боковыми цепями». Как мы теперь знаем, именно «боковые цепи» Эрлиха
– это подробно изученные к настоящему времени рецепторы лимфоцитов для АГ.
4
Положение о ведущей роли АТ в невосприимчивости поддержал Р.Кох. В
1908г. П.Эрлиху вручили Нобелевскую премию за гуморальную теорию
иммунитета.
В 1937 г. к. Ландштайнер выдвинул теорию прямой матрицы, т.е. определил
роль Аг как матрицы, под влиянием которой видоизменяются глобулиновые
структуры с целью образования специфических комплексов АГ+АТ. Однако
открытие феномена иммунологической толерантности показало
несостоятельность этой теории для объяснения такого явления.
Шведский иммунолог Н.К.Йерне (1955) предложил селекционную теорию,
или теорию естественного отбора, согласно которой каждая клетка синтезирует
большой ассортимент АТ. А проникший в организм АГ является не индуктором
образования АТ, а селективным фактором – отбирает комплементарные ему АТ и
связывается с ними. Затем этот комплекс доставляется к неким клеткам
организма, для которых он служит сигналом к продукции таких же АТ. Эта
теория впервые объясняла и вторичный АТ-ный ответ, и феномен
иммунологической толерантности.
И наконец, в 1964 г. Ф.М.Бернет обосновал клонально-селекционную
теорию, которой мы пользуемся в настоящее время. Он использовал
представления Эрлиха и Йерне о предсуществовании АТ разной специфичности,
5
но указывал на то, что каждое специфическое АТ синтезируется отдельным
клоном клеток. Эти клоны образуются при дифференцировке лимфоцитов (в
результате мутаций и рекомбинаций в хромосомах лимфоцитов) в центральных органах
иммунной системы и способны взаимодействовать только с АГ соответствующей
(«своей») специфичности. В результате такого взаимодействия происходит отбор
(селекция) одного клона, который либо секретирует АТ заданной специфичности,
либо обеспечивает строго специфическую клеточную реакцию.
Основные положения теории Бернета.
1. Популяция лимфоцитов в организме гетерогенна и состоит из клонов,
обладающих специфическими рецепторами на поверхности своих мембран
ко всем гипотетически возможным вариантам АГ.
2. Аг в организме является селективным фактором – он специфически
связывается с рецептором лимфоцита и «отбирает» определенный клон.
При этом запускаются механизмы пролиферации данного клона. Сигналами
к пролиферации служат связывание АГ и цитокины, которые выделяются
самой клеткой лил другими клетками.
3. При избыточной дозе АГ происходит гибель (элиминация) данного клона
лимфоцитов. Этим объясняется иммунологическая толерантность к «своим»
АГ.
6
4. Каждая плазматическая клетка синтезирует только 1 вид АТ.
Объяснение главного вопроса клонально-селекционной теории, а именно: как
возникает множество АГ-распознающих рецепторов в организме, - дал Тонегава с
помощью математического анализа в 1987г. Он предположил, что информация о
синтезе иммуноглобулиновых рецепторов в геноме лимфоцитов дискретна. На
этапе созревания и дифференцировки лимфоцитов в их геноме происходит
гибридизация разных локусов, кодирующих структуру вариабельных доменов
легких и тяжелых цепей АТ. Эта теория была подтверждена многочисленными
экспериментами, выполненными на молекулярно-генетическом уровне.
Свою биологическую функцию иммунная система осуществляет с помощью
сложного комплекса взаимосвязанных реакций. Этот сложный комплекс можно
подразделить на отдельные формы (проявления, феномены).
Основные иммунологические феномены:
1. Антителообразование
2. Иммунологическая память
3. Иммунологическая толерантность
4. Гиперчувствительность немедленного типа
7
5. Гиперчувствительность замедленного типа
6. Идиотип-антиидиотипические взаимоотношения.
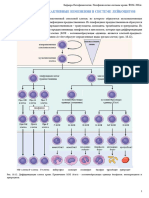
Иммунологическая память.
Феномен иммунологической памяти реализуется с помощью специальной
субпопуляции ИКК – лимфоцитов – клеток памяти.
Клетки памяти – это долгоживущие циркулирующие по сосудам малые
лимфоциты, которые являются частью субпопуляции Аг-специфического клона
лимфоцитов, сформированного в процессе первой стимуляции его антигеном.
Небольшая доля таких лимфоцитов (в количестве нескольких %%) резервируется
в организме в неактивном «дремлющем» состоянии (персистирует). Такие
лимфоциты – клетки памяти способны сохранять информацию об АГ, вызвавшем
первичный иммунный ответ, до 10-15 лет и более, иногда до конца жизни
индивидуума. При вторичном попадании того же АГ в данный организм клетки
иммунологической памяти стимулируются более низкой концентрацией этого Аг,
пролиферируют, обеспечивая быстрое увеличение клона антителообразующих
или антигенреактивных лимфоцитов данной специфичности, и индуцируют
значительно более быстрый и эффективный иммунный ответ и элиминацию
патогенна. Т.о. патоген «не успевает» вызвать развитие инфекционного процесса,
8
и организм оказывается защищенным от реинфекции, т.е. формируется
иммунитет.
Благодаря наличию в организме клеток памяти обеспечивается ускоренный
иммунный ответ по вторичному типу при повторном обнаружении данного
антигена в организме.
Т-клетки памяти играют большую роль в противоопухолевой защите
организма.
Иммунологическая толерантность
Иммунологическая толерантность – это отсутствие иммунного ответа на АГ
в связи с неспособностью его распознавания.
Феномен иммунологической толерантности был открыт в 1953 г. чешским
ученым М. Гашеком и группой английских ученых во главе с П. Медаваром.
Гашек в опытах на куриных эмбрионах, а Медавар - на новорожденных мышатах
показали, что организм становится нечувствительным к АГ при его введении в
эмбриональном или раннем постнатальном периоде.
АГ, вызывающий толерантность, называется толероген.
9
Следует различать иммунологическую толерантность и иммунную
супрессию (подавление иммунного ответа):
Толерантность – изначальная ареактивность ИКК к данному АГ (т.е.
активация специфического клона не начинается).
Супрессия – активация специфического клона ИКК начинается,
развивается, а затем подавляется.
Иммунологическая толерантность бывает врожденной и приобретенной.
Пример врожденной толерантности – отсутствие реакции иммунной системы
на свои собственные антигены. Этот феномен получил название центральной
толерантности. Приобретенную толерантность можно создать 1) либо вводя
в организм иммунодепрессанты, 2) либо вводя АГ в эмбриональном или раннем
постнатальном периоде. Установлено что активация АГ-специфического
рецептора (TCR или BCR) у незрелого лимфоцита вызывает в нем апоптоз.
Приобретенная толерантность может быть активной или пассивной.
Активная – после введения толерогена, пассивная – иммунодепрессантов. Обычно
иммунологическая толерантность наблюдается непродолжительный срок –
несколько дней. Для продления срока необходимы повторные инъекции
препарата.
10
Механизмы толерантности многообразны и до конца не изучены. Известно,
что в основе ее лежат нормальные процессы регуляции иммунной системы.
Выделяют 3 наиболее вероятные причины развития иммунологической
толерантности:
1. Элиминация из организма антигенспецифических клонов лимфоцитов.
2. Блокада биологической активности ИКК (посредством цитокинов).
3. Быстрая нейтрализация АГ АТ-ми (что предотвращает их связывание с
рецепторами ИКК – т.о. элиминирутся специфический активирующий
фактор).
Феномен иммунологической толерантности имеет большое практическое
значение при пересадке органов и тканей лечение аутоиммунных заболеваний
аллергий и других состояний, связанных с агрессивным поведением иммунной
системы.
Регуляция иммунитета
Для взаимодействия между собой в иммунном ответе клетки используют
либо прямой контакт, либо растворимые в окружающей среде факторы.
11
Механизм биологического распознавания, лежащий в основе иммунного
реагирования, подобен ключу и замку: рецептор - лиганд. На мембране клетки
имеются рецепторы, встроенные, подобно антенне, в билипидный ее слой, а в
окружающей среде - обратная копия этого рецептора в виде лиганда на
поверхности другой клетки или растворимого вещества. Соединяясь, они
образуют мощный реагент на поверхности клетки, который посредством быстрых
метаболических превращений сигнализирует внутрь клетки о начале, усилении
или прекращении присущей ей функции.
Известны 2 механизма такого взаимодействия:
1) адгезия клеток: мембранные молекулы одной клетки комплементарно
связываются с мембранными молекулами другой клетки, что приводит к
межклеточному контакту;
2) взаимодействие при помощи медиаторов: клетка синтезирует особые
молекулы – медиаторы (цитокины или интерлейкины), рецепторы к которым
присутствуют на мембранах других клеток. При связывании рецептора с
лигандом реализуется тот или иной биологический эффект.
Регуляция иммунитета осуществляется двумя основными способами:
активацией иммунной системы и супрессией иммунного ответа.
12
Активация иммунной системы – это развитие продуктивной иммунной
реакции в ответ на появление АГ в организме. После распознавания
чужеродности биоорганической молекулы запускается пролиферация
(размножение) и, чуть позже, дифференцировка высокоспецифичного для АГ
клона лимфоцитов, чтобы прервать АГ-ную интервенцию.
Супрессия, или подавление иммунного ответа, - это физиологическая
реакция организма, которая в норме завершает иммунный ответ и направлена на
торможение и удаление Аг-специфических клонов лимфоцитов.
Различают 3 механизма иммуносупрессии:
1. Элиминация антигенного стимула
2. Торможение активности ИКК
3. Уничтожение клонов ИКК, например путем апоптоза. При этом
элиминации подлежат следующие группы клеток:
Терминально дифференцированные лимфоциты, завершившие
свою биологическую программу;
Активированные лимфоциты, не получившие АГ-ного стимула;
«изношенные» лимфоциты;
Аутореактивные клетки.
13
Механизмы и факторы иммунорегуляции:
1). АГ – основной фактор иммунорегуляции: в его присутствии иммунный
ответ стимулируется, а при уменьшении концентрации – снижается. Удаление АГ
в природе наблюдается, например, при полном освобождении организма от
патогенна при развитии стерильного иммунитета.
2). Избыток АТ в организме вызывает резкое падение АТ-образования и
уменьшение числа клеток, секретирующих АТ (супрессия гуморального звена
иммунитета). Это вызвано тем, что IgG связываются со специальными
рецепторами на мембране В-лимфоцита и тормозят биологическую активность
клетки и ее способность дифференцироваться в плазмоцит.
Это частный случай эффективного механизма регуляции любой реакции,
когда продукт реакции одновременно служит ее ингибитором. Именно этот тип
отрицательной обратной связи имеет место при образовании АТ.
3). Т-клеточная регуляция включает активацию иммунного ответа Т-
хелперами (путем синтеза ИЛ-2) и подавление его Т-супрессорами (механизм
супрессии до конца не выяснен). Функциональная активность Т-л может быть
ингибирована растворимыми факторами (цитокинами) их конкурентов.
Например, Тх2 путем синтеза ИЛ-4 препятствует дифференцировке Тх0 в Тх1, а
Тх1, в свою очередь может блокировать образование Тх2 путем синтеза γ-ИФН.
14
4). В регуляции иммунного ответа немалая роль принадлежит генетическим
факторам – существуют гены, определяющие общую иммунореактивность.
5). На иммунореактивность влияют нейроэндокринные факторы (например,
глюкокортикоидные гормоны инициируют апоптоз). Иммунная система имеет
многочисленные двусторонние связи с другими жизнеобеспечивающими
системами, и в первую очередь с ЦНС и эндокринной системой. Центральный
орган иммунитета - тимус (вилочковая железа), в свою очередь, является звеном
системы гипоталамус - гипофиз - корковое вещество надпочечников - половые
железы. Поэтому достичь влияния на иммунную реакцию можно также
воздействием на ЦНС и эндокринную систему. На мембране
иммунокомпетентных клеток имеются рецепторы к нейромедиаторам и гормонам,
а выброс этих веществ в кровь и ткани включает ответную реакцию
чувствительных к ним клеток.
Такие взаимосвязи объясняют вовлеченность иммунной системы в патогенез
многих, на первый взгляд, неиммунных болезней, а также позволяют
опосредованно воздействовать на иммунитет. Так, например, противоболевое
лечение несет в себе одновременно элементы иммунотерапии и наоборот (яркий
пример - противоревматическое лечение).
15
Следовательно, для иммунной системы характерна четкая
сбалансированность и последовательность этапов реагирования, а при их
нарушении возникает патология, требующая иммунотерапии.
Дополнение
3. Функции клеток отдельных звеньев иммунной системы колеблются в
циркадном ритме, часто разнонаправленном, так, что повышению активности
одного звена соответствует снижение уровня другого. В циркадном ритме
функционируют форменные элементы крови, изменяется уровень
иммуноглобулинов и комплемента в сыворотке крови, интенсивность
образования антител, фагоцитоза, бластогенеза в смешанной культуре
лимфоцитов. Отторжение трансплантата имеет суточный или семисуточный ритм.
Чувствительность к аллергенам, проявления симптомов бронхиальной астмы и
ревматоидного артрита тоже носят периодический характер.
4. Все вещества, влияющие на иммунную реакцию на любом ее этапе,
называются иммунотропными. Они могут вырабатываться в самом организме или
быть введены в него извне (эндогенные или экзогенные). В зависимости от их
точки приложения они могут либо активировать иммунную реакцию, либо
16
усилить или ослабить ее конечный результат или промежуточный этап, либо
полностью или частично подавить иммунный ответ. Роль иммунотропных
веществ могут выполнять и нелекарственные агенты: физические и
психоэмоциональные факторы, пища, температурные воздействия. Т.о. при
многих обстоятельствах (например, при лекарственной аллергии, отсутствии
нужных медикаментов, их неэффективности) безмедикаментозное лечение
является методом выбора.
Кроме того, многоступенчатость иммунной реакции позволяет использовать
в качестве иммунотропных средств препараты, которые известны в фармакологии
как сердечные, противоопухолевые, психотропные, антисклеротические,
слабительные и др. Их действие, на первый взгляд вспомогательное, заключается
в обеспечении одного из механизмов реагирования системы иммунитета. Так,
например, ускорение рециркуляции жидкости или, напротив, дилатация сосудов
регулируют количественный состав клеток крови, в том числе представительство
ЕКК-, Т- и В -лимфоцитов, в нужный момент в нужной анатомической зоне.
Влияние циркадных ритмов на функционирование иммунной системы
указывает на то, что при назначении иммунотропных средств следует учитывать
законы хронотерапии, принимая во внимание данные (если они известны)
суточной активности мишеневого звена иммунитета. Например, цефалоспорин
17
третьего поколения - цефодизим, введенный внутривенно больному в 8.00,
повышал, а в 18.00 - снижал хемотаксис моноцитов (Dammaco F. и соавт., 1988).
Эффективность введения препаратов тимуса в вечернее время обусловливается
активацией эпифиза в ночное время и снижением глюкокортикоидной активности
коркового вещества надпочечников.
Иными словами, планируя лечение иммунотропными средствами, мы
должны представлять, что вмешиваемся в феномен иммунологической регуляции.
Вам также может понравиться
- PDFДокумент395 страницPDFSvetlana MalukОценок пока нет
- Allergija 1Документ6 страницAllergija 1Napas LavandosОценок пока нет
- ImmunologiayayayaДокумент48 страницImmunologiayayayaahmedelghallabyОценок пока нет
- 9. Immune GM ru 2022Документ27 страниц9. Immune GM ru 2022kabulkabulovich5Оценок пока нет
- Immunologia 2020 - PostnikovaДокумент257 страницImmunologia 2020 - PostnikovaNikitaОценок пока нет
- дифф иммункаДокумент47 страницдифф иммункаДаяна СагинтаеваОценок пока нет
- ImmunolekДокумент14 страницImmunolekp28dn9ppdcОценок пока нет
- план и вопросы к занятиям леч фак 2020Документ14 страницплан и вопросы к занятиям леч фак 2020elsaman00Оценок пока нет
- ИммунологияДокумент52 страницыИммунологияsevdaismailova13Оценок пока нет
- анатомо-физиологические особенности иммунной системыДокумент54 страницыанатомо-физиологические особенности иммунной системыRomanОценок пока нет
- 2. Виды иммунитета и формы иммунного ответаДокумент21 страница2. Виды иммунитета и формы иммунного ответаАмир СадретдиновОценок пока нет
- Лекция Иммунная система и её функцииДокумент35 страницЛекция Иммунная система и её функцииАмир СадретдиновОценок пока нет
- фагоцитоз микра (копія)Документ5 страницфагоцитоз микра (копія)daria.mrzv20Оценок пока нет
- 11 ИммДокумент35 страниц11 ИммDjgernaut DotinОценок пока нет
- Lektsia 1Документ72 страницыLektsia 1Tatiana KeorОценок пока нет
- Неспецифические и специфические факторы защиты организмаДокумент57 страницНеспецифические и специфические факторы защиты организмаАмир СадретдиновОценок пока нет
- Нармин poslДокумент30 страницНармин posllovehappyОценок пока нет
- Лекция №1Документ54 страницыЛекция №1Alexandra BaluhatayaОценок пока нет
- Невидимый страж: Как иммунитет защищает нас от внешних и внутренних угрозОт EverandНевидимый страж: Как иммунитет защищает нас от внешних и внутренних угрозОценок пока нет
- микраДокумент14 страницмикраIslam.medetov.04Оценок пока нет
- Главный комплекс гистосовместимостиДокумент9 страницГлавный комплекс гистосовместимостиdrakosha651Оценок пока нет
- ИммунологияДокумент56 страницИммунологияisaacoff013Оценок пока нет
- 8-9. Аллергия-лекция3284503844341091004Документ107 страниц8-9. Аллергия-лекция3284503844341091004Olya KroytorОценок пока нет
- МИКРОБ 1pptxДокумент23 страницыМИКРОБ 1pptxlovehappyОценок пока нет
- ИММУНОЛОГИЯДокумент19 страницИММУНОЛОГИЯAhmed AymanОценок пока нет
- Immunodefitsity Ptits CompressedДокумент150 страницImmunodefitsity Ptits CompressedadrОценок пока нет
- АллергияДокумент86 страницАллергияzubОценок пока нет
- 13 Имм АллерДокумент22 страницы13 Имм АллерDjgernaut DotinОценок пока нет
- ИммунитетДокумент16 страницИммунитетAzzeeОценок пока нет
- неврологияДокумент29 страницневрологияДмитрий МатвеевОценок пока нет
- Клетки. Для конспектаДокумент50 страницКлетки. Для конспектаmedi beisОценок пока нет
- БиологияДокумент1 страницаБиологияAndreyОценок пока нет
- Система гуморального иммунитетаДокумент11 страницСистема гуморального иммунитетаMazurencoIanaОценок пока нет
- 1. WBC GM ru 2024Документ14 страниц1. WBC GM ru 2024kabulkabulovich5Оценок пока нет
- Povrezhdenie KletkiДокумент79 страницPovrezhdenie Kletkivlad1nn999Оценок пока нет
- НарминДокумент30 страницНарминlovehappyОценок пока нет
- 14 Иммун 5 РеакцииДокумент19 страниц14 Иммун 5 РеакцииDjgernaut DotinОценок пока нет
- Основы Цитологии Структурная Организация КлеткиДокумент50 страницОсновы Цитологии Структурная Организация Клеткиc8jsy7pn42Оценок пока нет
- Immunitet ZadaniaДокумент3 страницыImmunitet ZadaniaРохманов НикитаОценок пока нет
- IMMUNOLOGIYa Lektsia 2 Immunnaya Sistema DocДокумент16 страницIMMUNOLOGIYa Lektsia 2 Immunnaya Sistema Docarthurbogning0Оценок пока нет
- Серологічні реакції для сероідентифікації. Реакція аглютинації та її різновиди.Документ7 страницСерологічні реакції для сероідентифікації. Реакція аглютинації та її різновиди.Ludmila BuzurniiОценок пока нет
- Obshaia Biologia Konspekt LeksiyДокумент89 страницObshaia Biologia Konspekt LeksiySa VeroniОценок пока нет
- Зайчик А Ш, Чурилов Л П ОсновыДокумент961 страницаЗайчик А Ш, Чурилов Л П ОсновыalikaОценок пока нет
- Патфиз 2Документ19 страницПатфиз 2nurlan.khodzhayevОценок пока нет
- Физиология с основами анатомии человека PDFДокумент471 страницаФизиология с основами анатомии человека PDFЛасточкаОценок пока нет
- Адельман Д. - Клиническая иммунология и аллергологияДокумент220 страницАдельман Д. - Клиническая иммунология и аллергологияIrina Moldovan100% (1)
- Экзосомы 2Документ21 страницаЭкзосомы 2Светлана ГородкоОценок пока нет
- иммунитет 1 лектор МишинаДокумент18 странициммунитет 1 лектор МишинаAuthentic IdiotОценок пока нет
- М-клетки слизистой оболочки кишечникаДокумент10 страницМ-клетки слизистой оболочки кишечникаЙозефОценок пока нет
- план лекций лечебный факультет 2020Документ1 страницаплан лекций лечебный факультет 2020elsaman00Оценок пока нет
- митозДокумент23 страницымитозsdsfsfgdfОценок пока нет
- 16 Иммун имм статусДокумент23 страницы16 Иммун имм статусDjgernaut DotinОценок пока нет
- 123906Документ26 страниц123906dietox.ruОценок пока нет
- Синдром системного воспалительного ответаДокумент7 страницСиндром системного воспалительного ответаAleksandr NikolaienkoОценок пока нет
- Molekuljarnaja Biologija Kletki v2Документ546 страницMolekuljarnaja Biologija Kletki v2api-3706027100% (1)
- 17 ЭшерихиозыДокумент28 страниц17 ЭшерихиозыDjgernaut DotinОценок пока нет
- аллергияДокумент46 страницаллергияdinakuchukovaОценок пока нет
- Poyasni Za PatologiyuДокумент108 страницPoyasni Za PatologiyuрозаОценок пока нет
- ЛЕКЦИЯ 1Документ47 страницЛЕКЦИЯ 1nazarovmuhammad1131Оценок пока нет
- АЛЛЕРГ 22-27430Документ43 страницыАЛЛЕРГ 22-27430Арнаут МихаелаОценок пока нет
- Исцеление перекисью водородаДокумент44 страницыИсцеление перекисью водородаazat nazarОценок пока нет
- ImmunologiaДокумент221 страницаImmunologiaNikitaОценок пока нет
- Адельман Д. - Клиническая иммунология и аллергологияДокумент220 страницАдельман Д. - Клиническая иммунология и аллергологияIrina Moldovan100% (1)
- Лекция №2 заболевания иммунной системы-конвертированДокумент47 страницЛекция №2 заболевания иммунной системы-конвертированНастяОценок пока нет
- Цитокины. Основы.Документ30 страницЦитокины. Основы.Pentotal NatriumОценок пока нет
- IMMUNOLOGIYa Lektsia 2 Immunnaya Sistema DocДокумент16 страницIMMUNOLOGIYa Lektsia 2 Immunnaya Sistema Docarthurbogning0Оценок пока нет
- Неспецифические и специфические факторы защиты организмаДокумент57 страницНеспецифические и специфические факторы защиты организмаАмир СадретдиновОценок пока нет